
Infections Gastro-Intestinales - September 18, 2023
Evaluation des méthodes de diagnostic de la gastro-entérite aiguë
Évaluation des méthodes de diagnostic de la gastro-entérite aiguë
La gastro-entérite aiguë est l’une des causes les plus fréquentes de morbidité et de mortalité dans le monde,1 la prévalence la plus élevée étant observée dans les pays non industrialisés car les maladies sont le plus souvent transmises dans de mauvaises conditions d’hygiène ou par la consommation d’aliments ou d’eau contaminés.2 Cependant, la gastro-entérite aiguë reste une affection courante dans les pays à faible revenu et élevé.3 Les symptômes et les complications de la gastro-entérite aiguë ont entraîné une charge de morbidité considérable en raison de l’utilisation croissante du système de santé et de la perte de productivité.3 Par exemple, aux Pays-Bas et en Belgique, les coûts médicaux directs annuels de la gastro-entérite aiguë s’élèvent respectivement à 945 millions d’euros et 112 millions d’euros.3,4 De même, en Finlande, la perte de productivité et le coût associé aux jours de travail perdus ont été estimés entre 1,8 et 2,1 millions d’euros, la prévalence des participants en congé de maladie relevée étant 3,54 fois plus élevée dans la semaine suivant une épidémie.5
La gastro-entérite aiguë est responsable de 1,45 million de décès dans le monde
La gastro-entérite est un trouble transitoire et elle peut être causée par une multitude d’agents pathogènes viraux, bactériens et parasitaires différents.6 Le norovirus est l’agent pathogène le plus courant responsable de la gastro-entérite aiguë aux États-Unis, suivi de Salmonellaspp., Shigella spp. et E-coli producteur de toxines Shiga (Figure 1).
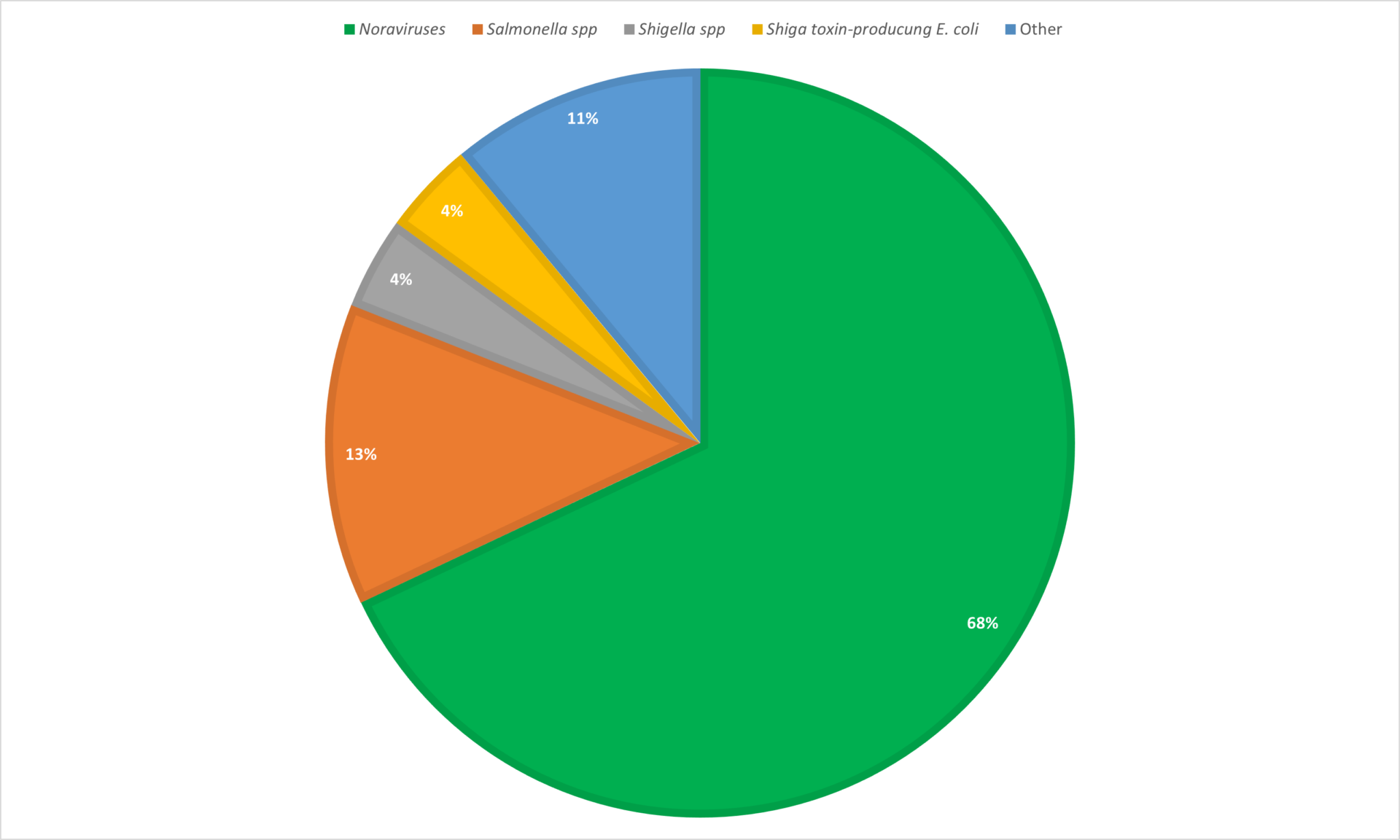
Figure 1. Pourcentage d’agents pathogènes responsables des épidémies de gastro-entérite aiguë à agent unique aux ÉtatsUnis depuis 20131
L’amélioration de l’assainissement a entraîné une réduction globale des infections bactériennes et parasitaires.1 Cependant, l’augmentation des hospitalisations liées à la diarrhée attribuée à la gastro-entérite aiguë virale a atteint des niveaux préoccupants avec au moins un agent viral dans près de 43 % des échantillons de diarrhée infantile dans les pays en développement.7
La gastro-entérite aiguë se caractérise par l’apparition soudaine d’une diarrhée et peut se présenter avec ou sans vomissements.6 La gastro-entérite aiguë est généralement une maladie spontanément résolutive et la plupart des personnes en bonne santé se rétablissent en quelques jours. Cependant, les complications peuvent s’avérer fatales pour les patients très jeunes ou très âgés.6 Les complications comprennent, mais sans s’y limiter, déshydratation, troubles électrolytiques, lésions rénales aiguës, septicémie et syndrome hémolytique et urémique.6 La diarrhée est la deuxième cause de décès chez les enfants de moins de 5 ans dans le monde.8 Il y a 1,7 milliard de cas de diarrhée et 1,45 million cas de décès dus à une gastro-entérite aiguë enregistrés chaque année dans le monde.1,2
Des dépistages rapides sont essentiels
Comme les nourrissons et les personnes âgées sont particulièrement sensibles aux complications résultant d’une gastro-entérite aiguë, l’obtention rapide de résultats aux tests permet de guider les professionnels de santé vers le type de traitement approprié pour les patients en soins intensifs.9 En outre, compte tenu de la nature hautement contagieuse de la maladie, les hôpitaux se retrouvent à court de structures d’isolement. Le nombre de lits est limité et en surdemande pour les patients non infectieux, sans parler des patients nécessitant un isolement pour prévenir la propagation de la gastro-entérite.10
Le dépistage rapide des infections gastro-intestinales peut réduire le temps d’isolement pour certains patients, réduisant ainsi la charge globale associée. Plusieurs techniques de diagnostic sont actuellement utilisées visant à améliorer la prise en charge des patients et à éviter les conséquences mortelles de la gastro-entérite aiguë. Dans la section suivante, nous les examinerons et soulignerons leurs principaux avantages.
Techniques de diagnostic conventionnelles par rapport aux tests moléculaires
Les diagnostics conventionnels des infections gastro-intestinales entériques reposent sur trois techniques principales : l’examen microscopique, les tests de culture et de sensibilité aux antibiotiques, et la détection des antigènes à l’aide d’immunodosages.1,2 Ces méthodes impliquent plusieurs étapes et procédures de sorte que les résultats peuvent tarder jusqu’à 3 jours.11 Pour les patients vulnérables, tels que les nourrissons, la santé peut décliner rapidement face à l’infection, donc, lorsque le temps est un facteur déterminant de la survie, la rapidité des techniques de diagnostic est impérative. Chaque technique de diagnostic conventionnelle présente des avantages et des inconvénients dans un contexte clinique.
Disparités de sensibilité pour le dépistage des parasites et des virus
L’examen microscopique reste la norme pour la confirmation biologique des infections parasitaires.12 La microscopie sur lame permet aux techniciens qualifiés de compter visiblement le nombre de parasites et elle permet un suivi rapide de l’efficacité d’un traitement donné.12
Bien que la microscopie ait été reconnue comme fournissant des résultats rapides, cela implique la manipulation d’un échantillon à la fois. Cela devient un problème à plus grande échelle dans un cadre clinique lorsque plusieurs échantillons sont en cause. La précision du diagnostic dépend également de la qualité du frottis, de l’équipement et des capacités du microscopiste.12 Des plateformes de diagnostic moléculaire sont disponibles, elles peuvent regrouper jusqu’à 24 échantillons en 3 heures et nécessitent moins de 2 minutes de temps de manipulation par échantillon.2
La microscopie électronique (EM) reste la méthode de référence pour le diagnostic de la gastro-entérite aiguë virale et l’électrophorèse sur gel de polyacrylamide (PAGE) a réussi à détecter les infections à rotavirus.13 Cependant, lorsqu’elle a été testée sur le dépistage du norovirus, l’EM a été enregistrée comme ayant une sensibilité de 58,3 %14 ce qui peut fausser des résultats. Une sensibilité de 90 % ou plus réduit le risque de résultats faussés. Ce risque peut être atténué en utilisant des techniques alternatives telles que la PCR qui a montré une sensibilité de 94,1 %.14 En plus d’être lentes et de précision variable, la microscopie, l’EM et la PAGE sont connues pour exiger une intense main-d’œuvre, nécessitant un équipement spécialisé et des techniciens de laboratoire expérimentés.2,11
En outre, un faible rendement positif d’agents pathogènes est un problème courant lors de l’utilisation de ces techniques conventionnelles. Des études antérieures ont indiqué un faible rendement positif de 2,4 % dans les cultures de selles et des taux encore plus faibles de 0,1 % chez les patients en soins intensifs.11 Même après concentration, le nombre minimal de particules virales présentes dans les échantillons de selles rend l’EM directe assez insensible.1
Dans un effort pour améliorer la sensibilité de l’EM pour la gastro-entérite aiguë virale, l’EM immunitaire (IEM) a été introduite, laquelle reposait sur l’ajout d’anticorps spécifiques ou de sérums immuns à l’échantillon pour améliorer le dépistage du virus.1 L’agglutination associée qui se produit en présence d’un anticorps spécifique améliore considérablement la capacité de diagnostic.1 Cependant, l’IEM requiert également une grande expertise technique et elle n’est utile que pour les échantillons prélevés aux tout premiers stades de l’infection.1
Problèmes liés à l’utilisation de la culture pour le diagnostic de la gastro-entérite aiguë
Les causes bactériennes sont responsables des cas graves de diarrhée infectieuse que les autres étiologies infectieuses avec une étude identifiant une origine bactérienne dans 87 % des cas.15 Les cultures de selles de routine peuvent identifier trois bactéries courantes : Salmonella, Campylobacter, et Shigella.15 Cependant, la culture de certains micro-organismes est difficile en laboratoire ou elle nécessite des conditions spécifiques qui, si elles ne sont pas remplies, entraîneront l’échec du dépistage de l’agent pathogène. Un autre problème majeur concerne les longs délais de diagnostic. Par exemple, le dépistage de Shigella par culture est possible mais doit être évité pour le diagnostic primaire en raison des longs délais d’exécution pouvant aller jusqu’à 5 jours.2,16 Les échantillons nécessiteront une longue période d’incubation et de nombreux facteurs affectent la sensibilité du résultat, notamment le type et la qualité de l’échantillon, l’âge du patient, le transport correspondant et les milieux de culture.2
La capacité des cultures à identifier les agents pathogènes a été examinée au fil des ans. Une étude a comparé le dépistage d’agents pathogènes à l’aide de méthodes conventionnelles, y compris la culture, à la PCR multiplex en temps réel sur 182 patients souffrant de diarrhée. L’étude a révélé que beaucoup plus d’agents pathogènes ont été détectés à l’aide du panel multiplex (58,3 %) par rapport aux études conventionnelles des selles (42,3 %).17 À cela s’ajoute une différence statistiquement significative dans le délai de rapport des tests, le panel multiplex confirmant le diagnostic en moyenne 25 h après la visite à l’hôpital, ce délai étant réduit à 4 heures pendant les heures de travail.17 Quoi qu’il en soit, le délai de rapport était significativement plus court que lors de l’utilisation de méthodes conventionnelles, lesquelles prenaient en moyenne 72 h.17
Ces données et les tests COVID-19 étant à la pointe des soins de santé, devrions-nous anticiper que les tests de diagnostic moléculaire deviendront une forme incontournable de test à l’avenir, les laboratoires ayant une plus grande capacité pour les tests de diagnostic moléculaire ?
Les progrès du diagnostic moléculaire permettent un diagnostic ciblé de la gastro-entérite aiguë
L’introduction des tests d’amplification des acides nucléiques (TAAN) a comblé le fossé entre les méthodes de diagnostic conventionnelles et les techniques de diagnostic moléculaire (DMx) plus performantes. Les TAAN se sont toujours révélés plus sensibles et spécifiques que les méthodes sans acide nucléique. Pour la gastro-entérite aiguë virale, le diagnostic peut être posé plus rapidement au cours de l’infection, même en cas de faible excrétion virale.1 Les TAAN identifient le pathogène en cause quelles que soient les contraintes de culture et démontrent une bonne reproductibilité entre laboratoires.18
Les tests DMx chez les individus symptomatiques sont devenus de plus en plus sophistiqués au cours des 20 dernières années et ces outils de diagnostic des gastro-entérites aiguës infectieuses ont connu plusieurs innovations allant de la culture scatologique au séquençage de nouvelle génération (SNG).11 Le SNG se caractérise par sa capacité à séquencer rapidement et intensément des génomes d’ADN ou d’ARN mixtes et il a déjà eu un impact substantiel sur notre compréhension de l’épidémiologie de nombreux agents pathogènes associés à la diarrhée.
Les tests basés sur le DMx disponibles dans le commerce ont changé la façon dont le diagnostic des infections entériques est effectué en laboratoire.2 Bien que les coûts des réactifs et des instruments soient plus élevés pour la technologie PCR en temps réel par rapport aux techniques conventionnelles, le niveau d’automatisation qui accompagne cette technologie réduit considérablement le temps de manipulation par échantillon, à seulement deux minutes.2 L’efficacité automatisée rend ce type de DMx ciblé beaucoup moins exigeant en main-d’œuvre que les techniques traditionnelles.
Les tests PCR se sont avérés aboutir systématiquement à des valeurs diagnostiques élevées, avec une sensibilité > 90 % et une spécificité proche de 100 %.11 Les tests basés sur la PCR multiplex évaluent simultanément les échantillons de selles pour y détecter la présence de plusieurs agents pathogènes, tandis que les plateformes uniques basées sur la PCR ciblent des agents pathogènes spécifiques.11 Les panels hautement multiplex courent le risque de fournir de faux positifs dans le cas d’agents pathogènes rares.19 De plus, il est important que la plateforme soit intégrée et n’exige pas d’extraction d’acide nucléique et de manipulation post-PCR séparées afin d’éviter la contamination et les faux positifs.2 Lorsque ces critères sont remplis, une approche syndromique ciblée peut être utilisée pour tester plusieurs agents pathogènes connus pour causer le même syndrome chez les patients. Les plateformes multiplexes intégrées ont un impact substantiel sur la prise en charge des patients par rapport aux plateformes uniques basées sur la PCR, avec le potentiel de réduire le délai de première identification d’un agent pathogène, d’influencer les résultats des patients grâce au démarrage précoce d’une antibiothérapie ciblée, de modifier la gestion des antimicrobiens et enfin, d’optimiser le contrôle des infections.20
Références
- Sidoti F, Rittà M, Costa C, et al. Diagnosis of viral gastroenteritis : limits and potential of currently available procedures. J Infect Dev Ctries 2015;9:551-561.
- Amjad M. An Overview of the Molecular Methods in the Diagnosis of Gastrointestinal Infectious Diseases. Int J Microbiol 2020;2020:1-13. Available at: https://www.hindawi.com/journals/ijmicro/2020/8135724/.
- Papadopoulos T, Klamer S, Jacquinet S, et al. The health and economic impact of acute gastroenteritis in Belgium, 2010–2014. Epidemiol Infect 2019;147:e146. Available at: https://www.cambridge.org/core/product/identifier/S095026881900044X/type/journal_article.
- Pijnacker R, Mangen M-JJ, van den Bunt G, et al. Incidence and economic burden of community-acquired gastroenteritis in the Netherlands: Does having children in the household make a difference? Riddle MS, ed. PLoS One 2019;14:e0217347. Available at: https://dx.plos.org/10.1371/journal.pone.0217347.
- Halonen JI, Kivimäki M, Oksanen T, et al. Waterborne Outbreak of Gastroenteritis: Effects on Sick Leaves and Cost of Lost Workdays. Nizami Q, ed. PLoS One 2012;7:e33307. Available at: https://dx.plos.org/10.1371/journal.pone.0033307.
- NICE. Gastroenteritis : Summary. NICE 2020. Available at: https://cks.nice.org.uk/topics/gastroenteritis/. Accessed October 1, 2021.
- Ramani S, Kang G. Viruses causing childhood diarrhoea in the developing world. 2009:477-482.
- Farthing M, Salam MA, Lindberg G, et al. Acute Diarrhea in Adults and Children. J Clin Gastroenterol 2013;47:12-20. Available at: https://journals.lww.com/00004836-201301000-00007.
- Freeman K, Mistry H, Tsertsvadze A, et al. Multiplex tests to identify gastrointestinal bacteria, viruses and parasites in people with suspected infectious gastroenteritis: a systematic review and economic analysis. Health Technol Assess (Rockv) 2017;21:1-188. Available at: https://www.journalslibrary.nihr.ac.uk/hta/hta21230.
- Sandmann FG, Jit M, Robotham JV, et al. Burden, duration and costs of hospital bed closures due to acute gastroenteritis in England per winter, 2010/11–2015/16. J Hosp Infect 2017;97:79-85. Available at: https://linkinghub.elsevier.com/retrieve/pii/S0195670117302852.
- Shen N, Tao Y, Du B-L, et al. Molecular diagnostic practices for infectious gastroenteritis. Chin Med J (Engl) 2020;133:1485-1486. Available at: https://journals.lww.com/10.1097/CM9.0000000000000841.
- CDC. Diagnosis ( Microscopy ). Cent Dis Prev Control 2021:2021. Available at: 02/08/2021CDC – Malaria – Malaria Worldwide – How Can Malaria Cases and Deaths Be Reduced? – Diagnosis (Microscopy)https://www.cdc.gov/malaria/malaria_worldwide/reduction/dx_microscopy.html. Accessed October 1, 2021.
- Beards GM. Laboratory diagnosis of viral gastroenteritis. Eur J Clin Microbiol Infect Dis 1988;7:11-13. Available at: http://link.springer.com/10.1007/BF01962164.
- Rabenau HF, Stürmer M, Buxbaum S, et al. Laboratory diagnosis of norovirus: Which method is the best? Intervirology 2003;46:232-238.
- Sattar SBA, Singh S. Bacterial Gastroenteritis.; 2021. Available at: http://www.ncbi.nlm.nih.gov/pubmed/30020667.
- Moro DD, David MO. Infectious Gastroenteritis: Causes, Diagnosis, Treatment and Prevention. Lupine 2019;2:1-6.
- Yoo IH, Kang HM, Suh W, et al. Quality Improvements in Management of Children with Acute Diarrhea Using a Multiplex-PCR-Based Gastrointestinal Pathogen Panel. Diagnostics 2021;11:1175. Available at: https://doi.org/10.3390/diagnostics11071175.
- Rodger AG, Morris-jones S, Huggett J, et al. The role of nucleic acid amplification techniques ( NAATs ) in the diagnosis of infective endocarditis. Br J Cardiol 2010;2010:195-200.
- Pankhurst L, Macfarlane-Smith L, Buchanan J, et al. Can rapid integrated polymerase chain reaction-based diagnostics for gastrointestinal pathogens improve routine hospital infection control practice? A diagnostic study. Health Technol Assess (Rockv) 2014;18:1-167. Available at: https://www.journalslibrary.nihr.ac.uk/hta/hta18530/.
- Chang L-J, Hsiao C-J, Chen B, et al. Accuracy and comparison of two rapid multiplex PCR tests for gastroenteritis pathogens: a systematic review and meta-analysis. BMJ Open Gastroenterol 2021;8:e000553. Available at: https://bmjopengastro.bmj.com/lookup/doi/10.1136/bmjgast-2020-000553.
BD MAX™ – automate et réactifs de biologie moléculaire pour la réalisation de tests de PCR en temps réel pour les laboratoires. Dispositifs médicaux de diagnostic in vitro de classe A et de classe C (IVDR 2017/746). Fabricant : Becton Dickinson and Company. Pour une bonne utilisation de ces produits, lire attentivement les recommandations d’utilisation. Edition Février 2023
bd.com/fr
BD, le logo BD et BD MAX sont la propriété de Becton, Dickinson and Compagny. ©2023 BD et ses filiales. Tous droits réservés. Becton Dickinson France S.A.S au capital de 64 719 915€ / RCS Grenoble B 056 501 711 / Siret 056 501 711 00115. BD-89359













